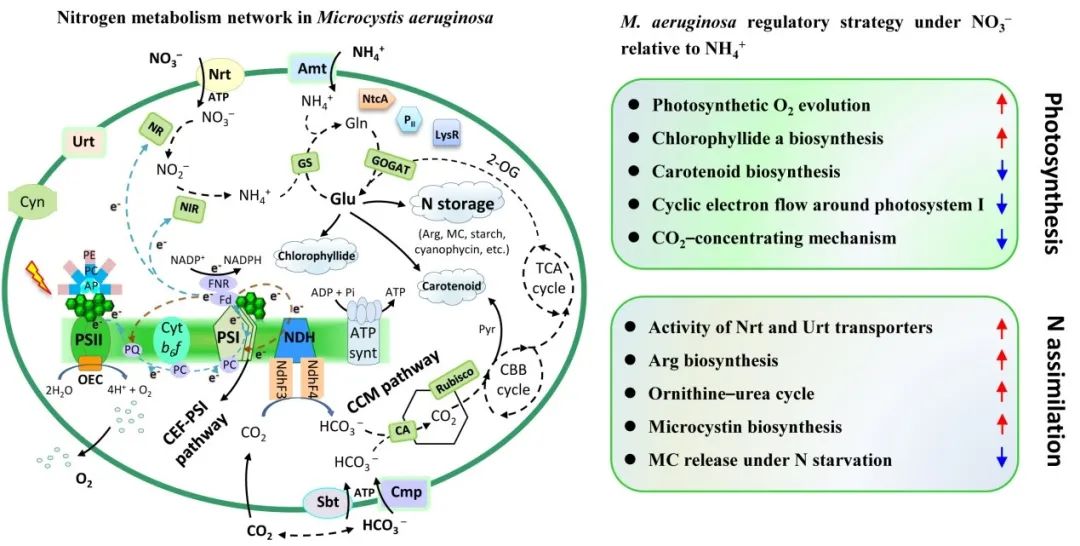
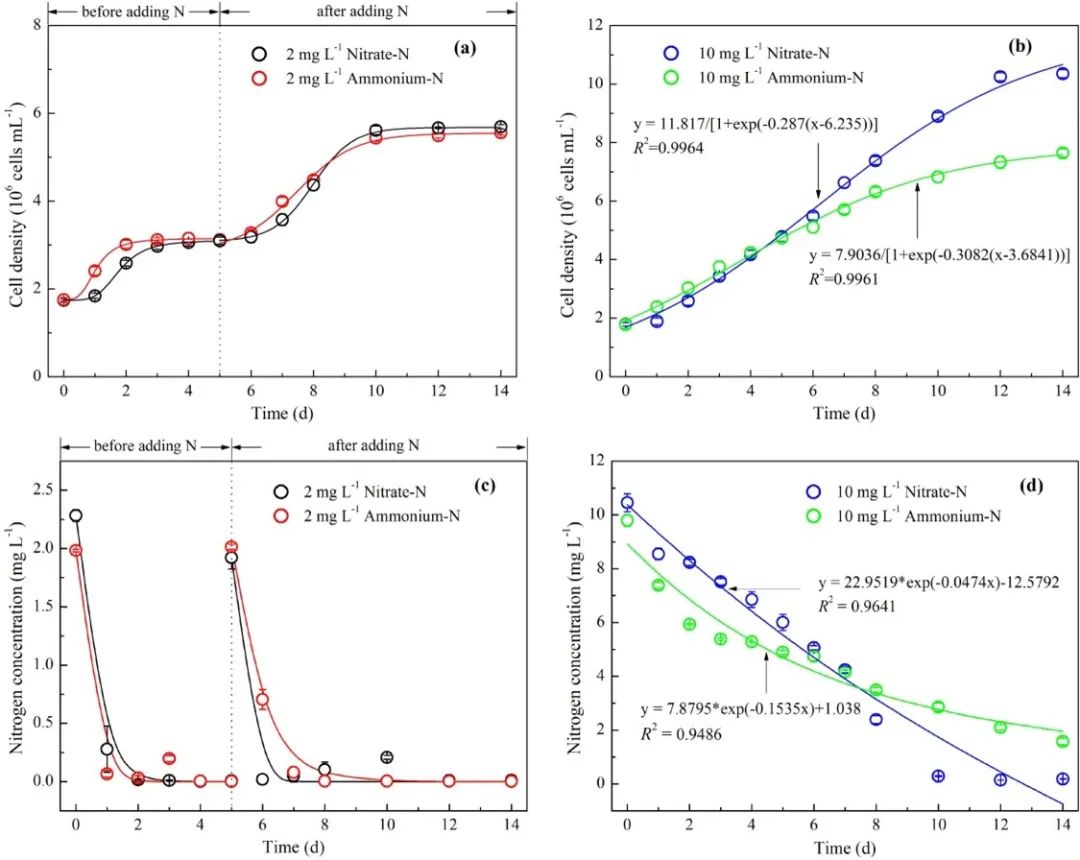
在本研究中,当氮源受限制时,铵态氮比硝酸盐更容易刺激铜绿假单胞菌的初始生长。即使当细胞再次缺乏氮时,再添加氮源后,氨组相对于硝酸盐组也观察到快速生长。当以铵态氮供应充足的培养时间延长时,从第5天开始的7天内,铜绿假单胞菌的生长变慢,而在同一时期观察到硝酸盐组促进了生长,是铵处理的1.36倍。同时测定培养液中氮含量的变化,结果显示与细胞的生长结果一致。
图1. 不同氮营养条件下铜绿假单胞菌生长和氮利用的变化。
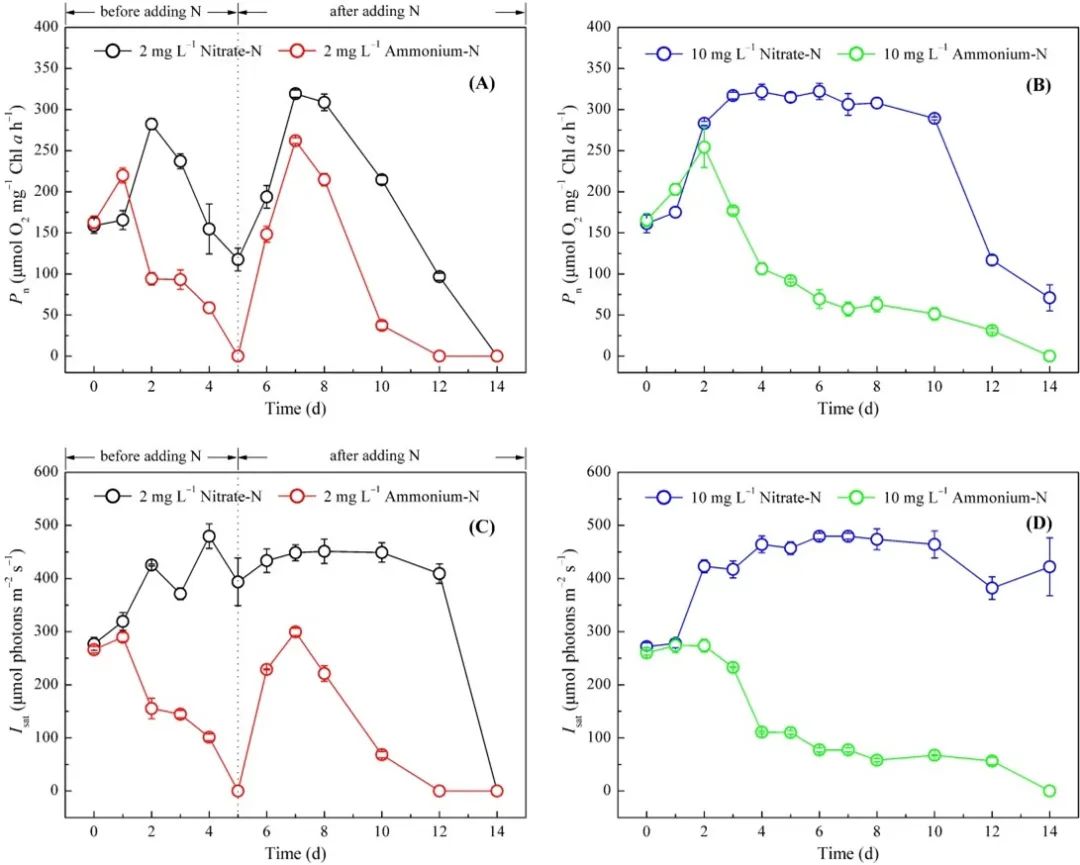
铜绿假单胞菌对铵供应的快速生长反应,培养一天后,所有铵组的净光合速率迅速增加,显著高于硝酸盐组。然而,在培养基中的氮含量耗尽后,2 mg/L氮处理组Pn值开始下降。这进一步强调了光合作用和氮代谢之间的密切关系。在10 mg-N/L组中,充足的硝酸盐供应确保了Pn的持续增加,之后由于氮耗尽,Pn降低。然而,氨氮处理的Pn在两天后急剧下降,一直低于初始值直到培养结束。这表明细胞周围过量的铵离子含量导致绿脓杆菌光合作用的下调。综合分析,将氧释放的减少可能归因于两个方面:一是由于过量的光能积累导致PSII的下调,另一个是通过与铵离子和水分子之间的OEC结合位点的竞争减少光驱动的水氧化。
图2. 不同氮营养条件下铜绿假单胞菌光合放氧(Pn)和饱和辐照度(Isat)的变化。
测定每个样本的MC产量,并将其计算为细胞配额值。结果表明硝酸盐培养有利于MC的生物合成,氮饥饿诱导毒素产生。当提供足够的氮时,硝酸盐下的MC总量在培养期间没有显著变化,但过量的铵会导致细胞内MC释放到环境中。
图3:不同氮营养条件下铜绿微囊藻胞内MC和胞外MC的变化
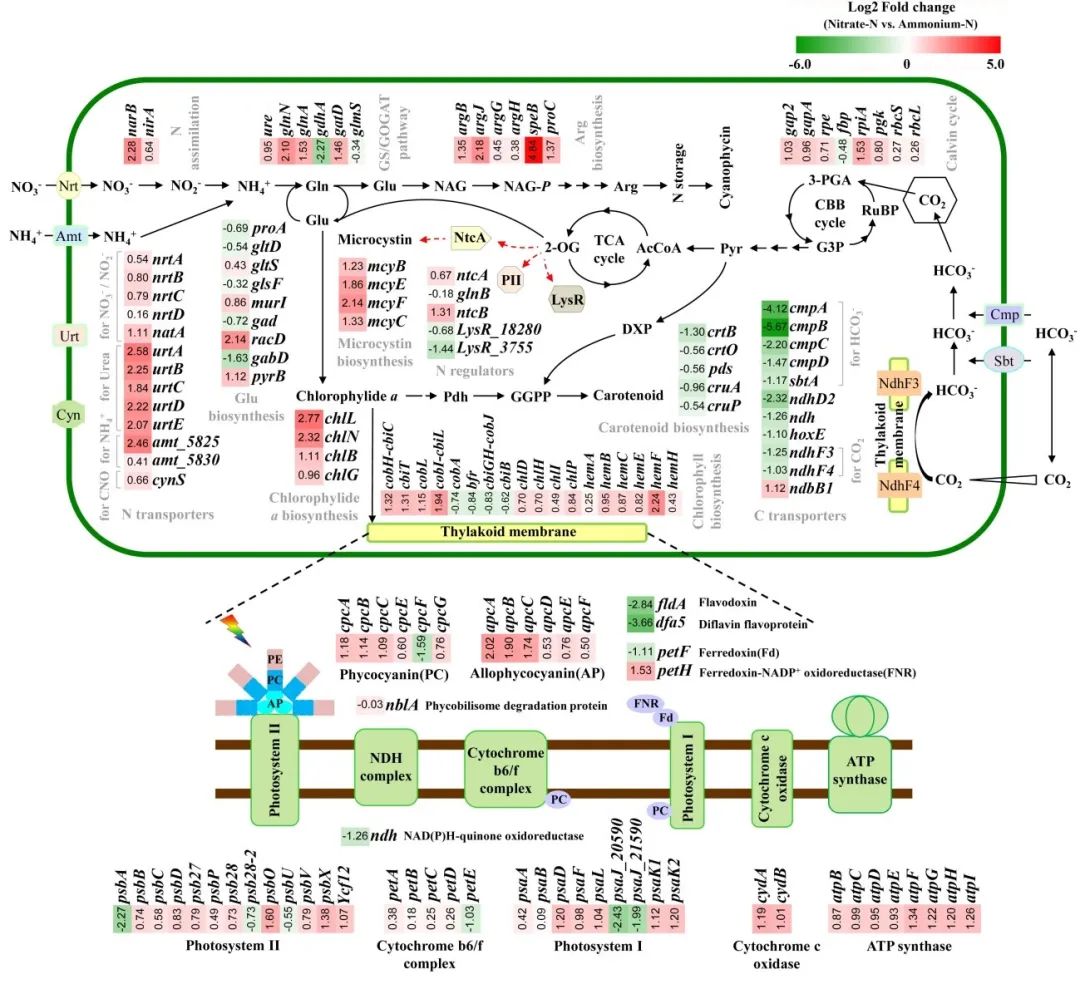
当环境中氮的浓度和形态随着营养条件的改变,细胞内氮代谢途径也相应改变。转录组分析结果表明,在硝酸盐培养的铜绿假单胞菌和氨氮培养的铜绿假单胞菌之间,超过14%的总基因表达存在显著差异。其中,400个基因上调,365个基因在硝酸盐条件下相对于铵态氮水平下调(图4A)。DEGs的层次聚类显示,具有类似功能或参与相同生物过程的基因聚集在同一组中,并且在组内的样本中观察到DEGs表达的重复性较好。
对差异表达基因进行GO富集分析,结果表明,493个DEG主要注释为21个GO功能分类。在生物过程类别中,含有大量DEG的次要功能是金属过程、细胞过程、生长和对刺激的反应,其中基因数量占所有富集基因的30.22%。细胞成分类别中,其中更多的基因富集在细胞和膜类别中。分子功能类别,其中51个基因在分子功能分支中高度富集。
KEGG富集分析结果显示,217个DEG被分别富集到85个KEGG通路中。其中67.28%基因在代谢通路中富集,包括能量代谢、碳水化合物代谢和氨基酸代谢等。此外,还富集到很多代谢途径,如ABC转运体、氧化磷酸化、光合作用,脂肪酸生物合成等等。
图4. 在硝酸盐上生长的铜绿假单胞菌中DEGs的聚类、GO网络分析和KEGG富集。
蓝藻含有吸收不同氮营养素的特定转运蛋白。编码ABC型硝酸盐/亚硝酸盐转运体的nrtABCD基因、编码铁氧还蛋白-亚硝酸盐还原酶的nirA基因、narB基因和铁氧还蛋白-硝酸还原酶基因的表达在硝酸盐环境下上调。这些基因通常存在于一个操纵子中,控制硝酸盐的吸收和同化。在氮的储存方面,生长在硝酸盐上的铜绿假单胞菌最为突出。该操纵子可能存在于铜绿假单胞菌中。然而,与聚球藻和鱼腥藻不同,在铜绿假单胞菌中未检测到glnK和nifI的表达,并且glnB的转录水平未发生差异性改变。铜绿假单胞菌PII及其编码基因的功能有待进一步研究。
当向绿脓杆菌提供硝酸盐时,光合作用相关基因的表达通常上调,与生长和生理变化一致。有趣的是,在铵胁迫下,铜绿假单胞菌光合作用不良的情况下,几个基因的表达显著上调。氨胁迫下,psbA基因的转录表达上调。psbA编码的D1蛋白是光介导的PSII损伤的主要靶点。因此,psbA的显著上调证实了Pn和Isat的变化所表明的结论,即充足的铵诱导光氧化PSII中的损坏。
RNA-seq结果显示,碳酸氢根转运蛋白和NdhF3~F4复合物,将细胞内CO2转化为铵态氮,相关编码基因上调。这些基因负责CO2 蓝藻中依赖于光能的浓缩机制(CCM),因此,铜绿假单胞菌也通过CCM维持其光合作用中的能量平衡。
sRNAs通过调控mRNAs的翻译和降解速率,在基因转录后调控中发挥着关键作用。为了更好地了解铜绿假单胞菌如何适应氮供应形式的变化,本研究确定了sRNAs及其靶点。结果表明,在硝酸盐和氨氮条件下培养的铜绿假单胞菌中检测到37个sRNA及其可能的靶蛋白编码基因的表达。然而,只有sRNA00003被注释为已知的蓝藻sRNA,即氮胁迫诱导的RNA 4(NsiR4)。近期有研究表明,NsiR4主要作为转录后调节因子,通过靶向编码GS失活因子7的gifA基因和编码含有DUF4090结构域的未知功能蛋白质的ssr1528基因,在GS的调节中发挥关键作用。然而,NsiR4对不同氮形态的反应目前尚不清楚。
对sRNA进行靶基因预测,并构建互作用网络。在4个sRNA(sRNA0004、sRNA0013、sRNA0022、sRNA0023)的目标中,超过20个。这些靶点涉及多种代谢途径,如氮的运输和储存、光合器官的组装、MC的产生、CO2的固定。这些发现为进一步的研究奠定了坚实的基础,这将为蓝藻如何利用sRNAs整合多种调节途径以响应营养变化提供新的线索。
图6. 调节对氮形态变化适应的sRNA-靶基因相互作用网络图。